Chưa có sản phẩm trong giỏ hàng.
Vai trò của xạ trị toàn thân lập thể trong ung thư biểu mô tế bào gan
Bài viết này chúng ta nói về vai trò của xạ trị toàn thân lập thể trong ung thư biểu mô tế bào gan. Việc sử dụng xạ trị toàn thân lập thể trong việc quản lý tất cả các bệnh nhân ung thư biểu mô tế bào gan (HCC) giai đoạn, với mục đích chữa bệnh, có khả năng chữa khỏi hoặc giảm nhẹ. Các thử nghiệm lâm sàng tiền cứu đã chứng minh rằng xạ trị toàn thân lập thể điều trị hiệu quả HCC, dẫn đến kiểm soát cục bộ thỏa đáng, dao động từ 75 – 100% sau 1 năm và 65 – 100% sau 2 năm.
1. Xạ trị toàn thân lập thể (SABR/SBRT) là gì?
Xạ trị toàn thân lập thể là một kỹ thuật tiên tiến của EBRT cung cấp liều chiếu xạ rất cao một cách rất chính xác trong một số phân đoạn điều trị hạn chế (tức là 3-6 phần và > 5 Gy mỗi phần) trong một đợt điều trị 1-2 tuần. Để phân phối xạ trị toàn thân lập thể tập trung và chính xác hơn, cần cung cấp các tiến bộ trong toàn bộ khoa xạ trị, bao gồm chẩn đoán hình ảnh, bất động, xác định mục tiêu, lập kế hoạch điều trị, hướng dẫn hình ảnh trên máy bay và quản lý chuyển động hô hấp (RMM). Chỉ IMRT hoặc VMAT nâng cao có hoặc không có thiết kế chùm tia không đồng phẳng mới có thể được sử dụng để phân phối xạ trị toàn thân lập thể.
Những tiến bộ này dẫn đến việc phân phối liều tốt hơn, cung cấp liều cao hơn trong khối u và tạo ra liều nhanh chóng rơi ra ngoài mục tiêu. Do đó, xạ trị toàn thân lập thể có thể cải thiện việc kiểm soát khối u và giảm liều chiếu xạ vào mô bình thường xung quanh, để giảm độc tính của xạ trị. Nhờ lợi ích kép này là tăng cường hiệu quả điều trị.
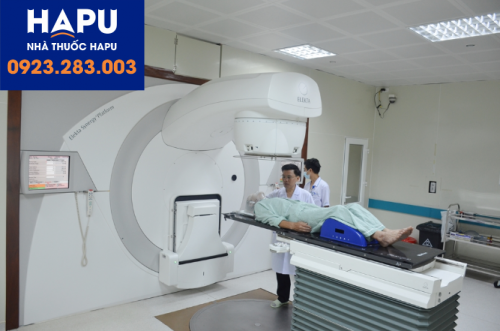
Xạ trị toàn thân lập thể là một kỹ thuật tiên tiến của EBRT
2. Vai trò của xạ trị toàn thân lập thể trong ung thư biểu mô tế bào gan
Gần đây, các bằng chứng lâm sàng đã phát triển nhanh chóng về việc sử dụng xạ trị toàn thân lập thể trong việc quản lý tất cả các bệnh nhân ung thư biểu mô tế bào gan (HCC) giai đoạn, với mục đích chữa bệnh, có khả năng chữa khỏi hoặc giảm nhẹ. Các thử nghiệm lâm sàng tiền cứu đã chứng minh rằng xạ trị toàn thân lập thể điều trị hiệu quả HCC, dẫn đến kiểm soát cục bộ thỏa đáng, dao động từ 75% đến 100% sau 1 năm và 65% đến 100% sau 2 năm.
Kiểm soát cục bộ ung thư biểu mô tế bào gan bằng cách sử dụng xạ trị toàn thân lập thể thường được định nghĩa là không có tiến triển hoặc không có bệnh tái phát trong phạm vi được chiếu xạ theo Tiêu chí đánh giá đáp ứng trong khối u rắn (RECIST) hoặc sửa đổi nó (mRECIST). Hơn nữa, xạ trị toàn thân lập thể cho thấy lợi ích của độc tính hạn chế, với tỷ lệ độc tính muộn nghiêm trọng là <15%; do đó, xạ trị toàn thân lập thể được coi là một phương thức an toàn để điều trị bệnh nhân cao tuổi.
Trong y văn, hầu hết bệnh nhân được điều trị bằng xạ trị toàn thân lập thể đều mắc bệnh Child-Pugh A và các tổn thương hạn chế (thường <3 khối u), việc phân phối xạ trị toàn thân lập thể ở bệnh nhân Child-Pugh B làm tăng tỷ lệ nhiễm độc. Tuy nhiên, nếu điều chỉnh liều được thực hiện để đáp ứng các hạn chế về mô bình thường ( tức là nghiêm ngặt) hơn thì xạ trị toàn thân lập thể có thể được cho phép đối với những bệnh nhân có HCC nhỏ với Child-Pugh B hoặc những người có khối u tương đối lớn hơn với điểm Child-Pugh là 7.
Xạ trị toàn thân lập thể như một phương thức điều trị thay thế cho liệu pháp cắt bỏ
Liệu pháp cắt bỏ được điều trị trong điều trị các khối u nhỏ ( tức là ≤ 3 cm) định vị ở một vị trí khả thi, đạt được tỷ lệ kiểm soát cục bộ tuyệt vời khoảng 70-90%; những kết quả này tương tự như kết quả của phẫu thuật cắt bỏ. Trong điều kiện như vậy, liệu pháp cắt bỏ được coi là một phương pháp điều trị thay thế cho phẫu thuật cắt bỏ hoặc ghép gan.Gần đây, xạ trị toàn thân lập thể cho thấy kết quả tương đương với RFA. Wahl và cộng sự so sánh kết quả điều trị giữa xạ trị toàn thân lập thể và RFA họ tuyên bố rằng cả hai đều có hiệu quả đối với bệnh nhân mắc ung thư biểu mô tế bào gan không thể phẫu thuật, với khả năng tự do tiến triển cục bộ (FFLP) và tỷ lệ OS tương đương. Tỷ lệ FFLP trong 1 và 2 năm của xạ trị toàn thân lập thể lần lượt là 97,4% và 83,8% so với 83,6% và 80,2% đối với RFA. Tỷ lệ OS trong 1 và 2 năm cũng tương tự giữa hai phương thức điều trị. Đáng chú ý, đối với các khối u lớn hơn 2 cm, xạ trị toàn thân lập thể chứng minh FFLP tốt hơn so với RFA [tỷ lệ nguy cơ (HR), 3,35; Khoảng tin cậy 95% (CI): 1,17-9,62; P = 0,025]Hara và cộng sự đã sử dụng đối sánh điểm xu hướng (PSM) để đánh giá các đặc điểm trước điều trị của giai đoạn BCLC, tình trạng chụp cắt lớp vi tính (CT) và kích thước khối u. Họ đã báo cáo tỷ lệ OS trong 3 năm tương đương giữa RFA và xạ trị toàn thân lập thể. Kim và cộng sự cũng áp dụng PSM để so sánh kết quả điều trị của xạ trị toàn thân lập thể và RFA. Tỷ lệ FFLP trong hai năm là 74,9% đối với nhóm xạ trị toàn thân lập thể và 64,9% đối với nhóm RFA. Kết hợp những dữ liệu này lại với nhau, xạ trị toàn thân lập thể thể hiện vai trò mới nổi như một phương thức điều trị chữa bệnh thay thế cho liệu pháp cắt bỏ để quản lý bệnh nhân ung thư biểu mô tế bào gan.
Xạ trị toàn thân lập thể như một liệu pháp thay thế hoặc bổ trợ cho các liệu pháp điều trị theo hướng động mạch
Trong số các liệu pháp điều trị bằng động mạch, TACE là phương thức điều trị được sử dụng rộng rãi nhất để quản lý bệnh nhân HCC giai đoạn trung gian, được áp dụng ở 50% -60% bệnh nhân. Tuy nhiên, chỉ riêng TACE đã cho thấy sự kiểm soát địa phương không đạt yêu cầu. Tỷ lệ đáp ứng thấp không thể chấp nhận được này cho thấy việc sử dụng liệu pháp tại chỗ, chẳng hạn như xạ trị toàn thân lập thể, như một liệu pháp thay thế hoặc bổ trợ để cải thiện kiểm soát tại chỗ.
Xạ trị toàn thân lập thể như một liệu pháp thay thế cho TACE
Sapir và cộng sự đã sử dụng PSM với xác suất trọng số điều trị nghịch đảo để so sánh xạ trị toàn thân lập thể và TACE ở bệnh nhân HCC có 1-2 khối u. Họ nhận thấy rằng xạ trị toàn thân lập thể có tỷ lệ kiểm soát cục bộ tốt hơn trong 1 và 2 năm khi so sánh với TACE: 97% và 91% so với 47% và 23% (HR, 66,5; KTC 95%: 18,99-233,0; P <0,001), tương ứng. Tuy nhiên, sự khác biệt về hệ điều hành không có sự khác biệt đáng kể giữa hai phương thức điều trị.
Xạ trị toàn thân lập thể kết hợp với TACE
Một số nghiên cứu hồi cứu và tổng quan đã chứng minh tỷ lệ kiểm soát cục bộ tăng lên bằng cách thêm xạ trị thông thường vào TACE. Tuy nhiên, các nghiên cứu sử dụng xạ trị toàn thân lập thể để thay thế xạ trị thông thường rất khan hiếm vì xạ trị toàn thân lập thể là một kỹ thuật mới.
Một nghiên cứu thử nghiệm và kết quả sơ bộ của các nghiên cứu tiền cứu cũng khẳng định tính an toàn và hiệu quả của xạ trị toàn thân lập thể ở bệnh nhân HCC không đáp ứng với TACE. Kang và cộng sự đã công bố một thử nghiệm pha-II thu nhận 47 bệnh nhân được điều trị TACE từ 1 đến 5 lần trước khi xạ trị toàn thân lập thể. Kết quả cho thấy phản ứng tốt, tỷ lệ kiểm soát cục bộ trong 2 năm là 94,6%. Hơn nữa, 38,3% bệnh nhân đạt được phản ứng hoàn toàn trong vòng 6 tháng. Tuy nhiên, vẫn không có dữ liệu được công bố từ các thử nghiệm đối đầu so sánh TACE cộng với xạ trị toàn thân lập thể với TACE đơn thuần. Một số thử nghiệm lâm sàng đang được tiến hành.
Xạ trị toàn thân lập thể kết hợp với TARE
Trước đây, có nhiều lo ngại về việc gia tăng độc tính do bức xạ khi sử dụng xạ trị toàn thân lập thể sau khi TARE. Hardy-Abeloos và cộng sự gần đây đã báo cáo rằng TARE sau đó là xạ trị toàn thân lập thể có độ an toàn và hiệu quả tương đương với TACE sau đó là xạ trị toàn thân lập thể.
Xạ trị toàn thân lập thể như một cầu nối để ghép gan
Một trong những phương pháp điều trị tiêu chuẩn vàng được ưa chuộng để quản lý bệnh nhân HCC là ghép gan, nhưng chỉ một số ít bệnh nhân có cơ hội được ghép do nguồn gan hiến không đủ. Do đó, một số liệu pháp cục bộ và cục bộ khu vực cho HCC đã được sử dụng để làm cầu nối chăm sóc ở những bệnh nhân tìm kiếm cấy ghép, nhằm trì hoãn sự tiến triển của khối u. Một số nghiên cứu đã chỉ ra rằng xạ trị toàn thân lập thể có thể là một giải pháp thay thế tuyệt vời cho các liệu pháp thông thường như một cầu nối để cấy ghép. Sapisochin và cộng sự đã báo cáo tỷ lệ sống sót của bệnh nhân tính toán theo tính toán, 3 và 5 năm kể từ thời điểm niêm yết lần lượt là 83%, 61% và 61% trong nhóm xạ trị toàn thân lập thể, tỷ lệ này tương đương với tỷ lệ của nhóm TACE hoặc RFA.
Xạ trị toàn thân lập thể cho xâm lấn mạch máu vĩ mô hoặc huyết khối tĩnh mạch cửa
Trong những thập kỷ qua, 2 thử nghiệm ngẫu nhiên mang tính bước ngoặt cho thấy sorafenib mang lại thời gian sống sót khiêm tốn ở bệnh nhân huyết khối tĩnh mạch cửa (PVT). Tuy nhiên, tỷ lệ phản hồi không đạt yêu cầu (chỉ 2%). CFRT đã được sử dụng rộng rãi trong HCC tiên tiến với xâm lấn mạch máu vĩ mô hoặc PVT vì nó có thể được phân phối bất kể vị trí khối u, và các mạch lớn chứng tỏ khả năng chịu bức xạ cao.
Rim và cộng sự đã xuất bản một phân tích tổng hợp và tổng quan hệ thống so sánh 3DCRT, TARE và xạ trị toàn thân lập thể ở bệnh nhân PVT. Không có sự khác biệt đáng kể về hệ điều hành giữa ba phương thức điều trị, nhưng xạ trị toàn thân lập thể cho thấy tỷ lệ đáp ứng cao nhất là khoảng 70%. Đáng chú ý hơn, độc tính trên mức 3 rất hiếm trong nhóm xạ trị toàn thân lập thể. Những dữ liệu này tiết lộ rằng xạ trị toàn thân lập thể có thể được áp dụng một cách an toàn ở những bệnh nhân bị PVT, với tỷ lệ đáp ứng tốt hơn so với CFRT.
Xạ trị toàn thân lập thể so với sorafenib
Brade và cộng sự bắt đầu thử nghiệm pha-I để đánh giá sự kết hợp giữa sorafenib và xạ trị toàn thân lập thể. Sorafenib được phân phối trước, trong và sau xạ trị toàn thân lập thể. Các nhà nghiên cứu nhận thấy rằng việc sử dụng đồng thời xạ trị toàn thân lập thể với sorafenib làm tăng đáng kể các tác dụng phụ, ví dụ như nhiễm độc ruột cấp 3+ và vỡ khối u. Vì vậy, họ không khuyến nghị sử dụng sự kết hợp này bên ngoài thử nghiệm lâm sàng. Một thử nghiệm lâm sàng (xạ trị OG 1112) đang được tiến hành để so sánh xạ trị toàn thân lập thể tiếp theo là sorafenib với sorafenib đơn độc ở những bệnh nhân mắc ung thư biểu mô tế bào gan tiến triển.
Xạ trị toàn thân lập thể như một cầu nối để ghép gan
3. Kết luận
Đối với bệnh nhân ung thư biểu mô tế bào gan với bất kỳ giai đoạn bệnh nào, xạ trị đóng một vai trò quan trọng, cho dù được thực hiện đơn lẻ hay kết hợp với các phương thức điều trị khác, vì nó không bị giới hạn bởi vị trí khối u. Hiện tại, việc thiếu bằng chứng cấp độ III là rào cản chính đối với việc khuyến nghị SBRT như một tiêu chuẩn chăm sóc trong hầu hết các hướng dẫn điều trị quốc tế. Về vấn đề này, một số thử nghiệm lâm sàng về SBRT đối với HCC đang được tiến hành. Trong kỷ nguyên hiện đại, vai trò của xạ trị chính xác dựa trên photon và proton trong việc quản lý bệnh nhân mắc ung thư biểu mô tế bào gan đang chuyển liên tục từ mục đích giảm nhẹ sang mục đích chữa bệnh.
Để biết thêm thông vui lòng liên hệ với Nhà thuốc Hapu qua số hotline 0923 283 003 hoặc truy cập vào website https://nhathuochapu.vn để được hỗ trợ tư vấn 24/7
